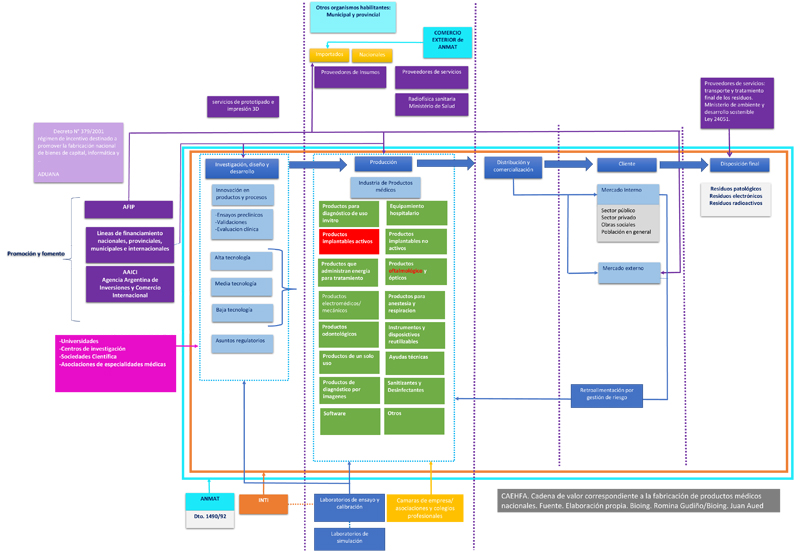
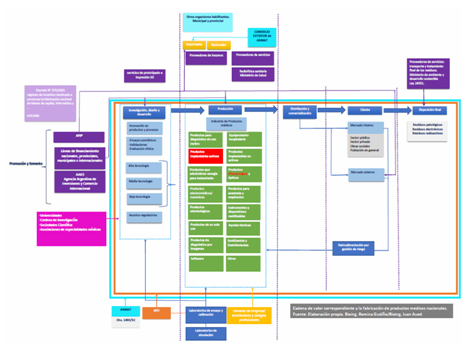
Cadena de Valor
Caracterización del complejo sector de los PM
1. Caracterización del sector salud
El sistema de salud argentino se caracteriza por la presencia de tres subsistemas, cuyas dinámicas son heterogéneas: El sector público, de la seguridad social y el sector privado (Fig.1).
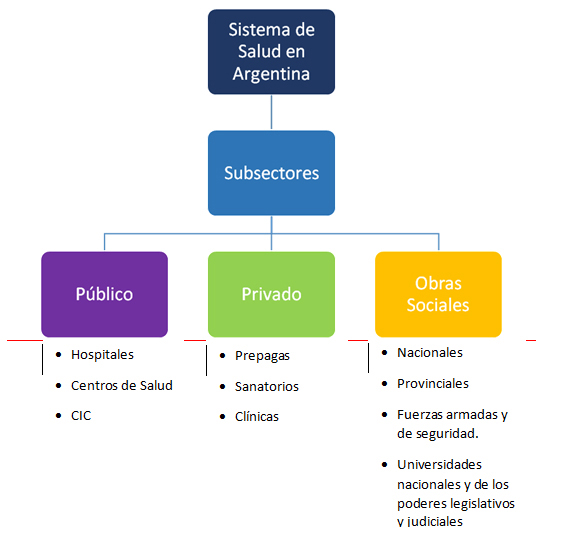
Fig.1 Subsectores del sistema de salud.
A su vez estos subsistemas se encuentran fragmentados en distintas fuentes de financiamiento, diferentes coberturas, coseguros y copagos aplicados como así también diferentes regímenes y órganos de control y fiscalización.
El subsector público, presta servicios a la población a través de hospitales y de los centros de salud, los gobiernos provinciales y municipales tienen los establecimientos de atención bajo su jurisdicción y son los responsables directos de la misma. Esta división fragmenta el sistema, porque cada uno de ellos queda sometido a normativas dictadas por las distintas jurisdicciones.
El subsector de la seguridad social, está conformado por fondos en su mayoría administrados por los sindicatos. Existe una amplia cantidad de obras sociales con diferentes alcances y tamaños.
Implica cinco universos diferentes:
- Obras sociales nacionales y, entre ellas, una de especiales características: el Instituto Nacional de Servicios Sociales para Jubilados y Pensionados (habitualmente conocido como PAMI, siglas de Plan de Atención Médica Integral).
- Obras sociales provinciales (una por cada provincia y la Ciudad Autónoma de Buenos Aires).
- Obras sociales de las Fuerzas Armadas y de Seguridad.
- Obras sociales de las universidades nacionales y de los poderes Legislativo y Judicial.
- Obras sociales sindicales.
El subsector privado, que, en lo que hace a los seguros voluntarios (medicina prepaga), se halla expresado en numerosas entidades de salud como clínicas y sanatorios.
En el año 2017 el sistema de salud argentino contaba con 17.485 establecimientos asistenciales incluyendo los de gestión pública, de la seguridad social y del sector privado. De ellos, 14.534 establecimientos son sin internación y de los cuales 6.456 son del subsector público (45%) y 3.311 establecimientos con internación de los cuales 1.271 son del subsector público (38%).
El Sistema de Salud actual en cualquier parte del mundo, ya no es más una relación aislada médico-paciente, sino una estrecha colaboración y sólidas alianzas entre los gobiernos, los dispensadores de atención de salud, la industria, las asociaciones, organizaciones profesionales, científicas y técnicas que no deben considerarse de manera aislada si no combinadas, tal como se muestra en la figura 2. Una de las prioridades debe ser la de fortalecer y ampliar las instituciones, que pueden trabajar eficazmente con los usuarios, para determinar las necesidades, emprender investigaciones biomédicas a fin de mejorar los dispositivos existentes o desarrollar otros nuevos que sirvan para satisfacer dichas necesidades.
Dos de los actores principales del sistema de salud son el sector de la tecnología médica, que alimenta con productos tecnológicos y servicios al Sistema y el sector farmacéutico que tiene como finalidad el desarrollo, producción, distribución y venta tanto de principios activos como de medicamentos destinados al consumo humano.
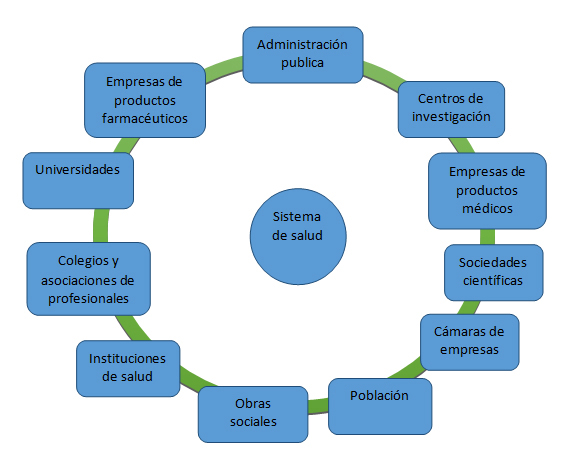
Fig.1 Actores que conforman el sistema de salud.
1.1 Sector de productos médicos
Las tecnologías médicas o sanitarias son esenciales para el funcionamiento del sistema de salud. Éstas salvan vidas y/o mejoran la calidad de vida de las personas, siendo indispensables para la prevención, el diagnóstico y el tratamiento de enfermedades y dolencias. Los dispositivos médicos como las ayudas técnicas, son importantes para la rehabilitación de los pacientes, además de ayudar a las personas con discapacidad a mantener su vida cotidiana.
Existen en el mundo más de 10.000 tipos diferentes de productos médicos . Nuestro país es el segundo más grande, por área, en América Latina después de Brasil. Con una población aproximada de 49 millones de personas, es el cuarto país más poblado de la región y la tercera economía más grande, solo superada por Brasil y México .
Se entiende por «dispositivo médico» todo instrumento, aparato, utensilio, máquina, implante, reactivo in vitro o calibrador, software, material o producto similar o relacionado:
a) concebido por el fabricante para ser empleado, solo o en combinación, en seres humanos con alguno(s) de los siguientes fines: diagnóstico, prevención, vigilancia, tratamiento o alivio de enfermedades; diagnóstico, vigilancia, tratamiento, alivio o compensación de una lesión; investigación, sustitución, modificación o apoyo de la anatomía o de un proceso fisiológico; apoyo o mantenimiento de la vida; control de la concepción; desinfección de otros dispositivos médicos; suministro de información con fines médicos o diagnósticos mediante el examen in vitro de muestras extraídas del cuerpo humano; y
b) que no logra el efecto principal perseguido en o sobre el organismo humano por medios farmacológicos, inmunológicos o metabólicos, pero puede ver dicho efecto facilitado si se usan esos medios.
Estos dispositivos deben ser evaluados durante todo el ciclo de vida del producto, desde la concepción hasta su disposición final que comprende: diseño, fabricación y reglamentación, preventa y posventa, uso apropiado y retirada de servicio para evitar el uso inapropiado garantizando la calidad, seguridad y eficacia. Se requieren políticas de acuerdo a las prioridades locales y nacionales que se adapten a las distintas funciones específicas del sector salud para ayudar en la mejora de la seguridad del paciente y la calidad de la atención de salud reforzando las áreas que se dedican a cada una de las etapas nombradas anteriormente.
Un aspecto importante a tener en cuenta en esto dispositivos es garantizar la continuidad de los servicios, planificando, evaluando, adquiriendo y gestionando cada una de las etapas.
El sistema de salud debe ser capaz de identificar los dispositivos obsoletos, sustituibles por los nuevos que van surgiendo y que impactarán, mejorando la calidad de atención del sistema de salud.
Los dispositivos médicos, ya sean importados o de fabricación nacional, deben cumplir normas nacionales e internaciones y requisitos clínicos de manera de aportar beneficios de salud pública, sin perjudicar a los pacientes, el personal de salud y el entorno.
1.2 Cadena de valor
En la siguiente grafica se puede observar la cadena de valor que caracteriza a este sector en lo que respecta a la fabricación de dispositivos médicos. Como se puede observar, consta de varios segmentos: Investigación, diseño y desarrollo; Producción; Distribución y comercialización; y disposición final.
http://www.imdrf.org/docs/ghtf/final/sg1/technical-docs/ghtf-sg1-n071-2012-definition-of-terms-120516.pdf#search=
http://www.imdrf.org/index.asp
1.3 Descripción de los segmentos. Investigación, diseño y desarrollo.
La cadena de valor, comienza con este ítem, Investigación, diseño y desarrollo de procesos o de productos. En nuestro país, las empresas desarrollan diferentes tipos de productos médicos que, clasificados de acuerdo a su tecnología podemos catalogarlos como de Alta, media o baja tecnología.
Para poder desarrollar esta actividad es necesario conocer el marco normativo y regulatorio del producto que se va a desarrollar. Conocer el estado de ese desarrollo, analizando y buscando publicaciones, patentes de invención o productos similares. Es necesario en esta etapa, conocer todo lo que rodea a ese producto para determinar la factibilidad y sustentabilidad de la su fabricación.
Es necesario tener un amplio conocimiento, porque de este estudio va a surgir si mi producto de acuerdo al tipo: va a necesitar ensayos técnicos, si tienen una norma aplicable, si necesitamos realizar una validación clínica, una evaluación clínica o ensayos preclínicos.
Las relaciones que tiene la empresa o emprendedor son importantes a tener en cuenta: el ámbito académico, los centros de investigación, las sociedades científicas como también las asociaciones de especialidades médicas, laboratorios públicos y privados de ensayos y calibración, laboratorios de simulación etc. Cada uno de estos actores aportaran a su manera en esta etapa.
En esta etapa, las políticas deben centrarse en ofrecer incentivos a la industria para que genere productos innovadores ya sea orientadas a investigación y desarrollo. En nuestro país, para estos inicios, se cuenta con varias líneas de financiamiento que ayudan a la producción y fomento de esta actividad.
Con el cambio constante de la tecnología y la incorporación de las misma, surgieron hace unos años los laboratorios de prototipado e impresión 3d que también en este punto son importantes.
Una vez que se llegó a la etapa de desarrollo, obteniéndose el prototipo se pasa a la etapa de reglamentación y producción.
Producción
Existen bienes intensivos en tecnología asociados a las empresas con mayor capacidad de I+D+i, entre los cuales se distinguen principalmente la fabricación de equipos y accesorios para diagnóstico por imágenes, neonatología, neumología, anestesiología, oxigenoterapia y diagnóstico clínico, y la producción de diversas clases de implantes.
Desde el Observatorio de Tecnología Médica se viene trabajando en una clasificación (“árbol”) del sector desde el año 2012. Al día de hoy, se clasifica la información contenida en el Observatorio, en las siguientes categorías (figura 3): equipamiento médico (electromédico, imágenes, etc.), implantables (activos y no activos), descartables, esterilización, desinfección y limpieza.
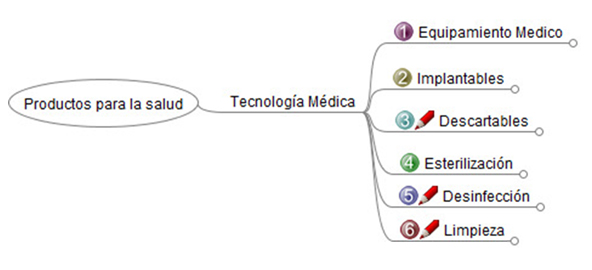
A su vez, cada una estas categorías se abren en ramificaciones que parametrizan al sector (figuras 4 a 6).
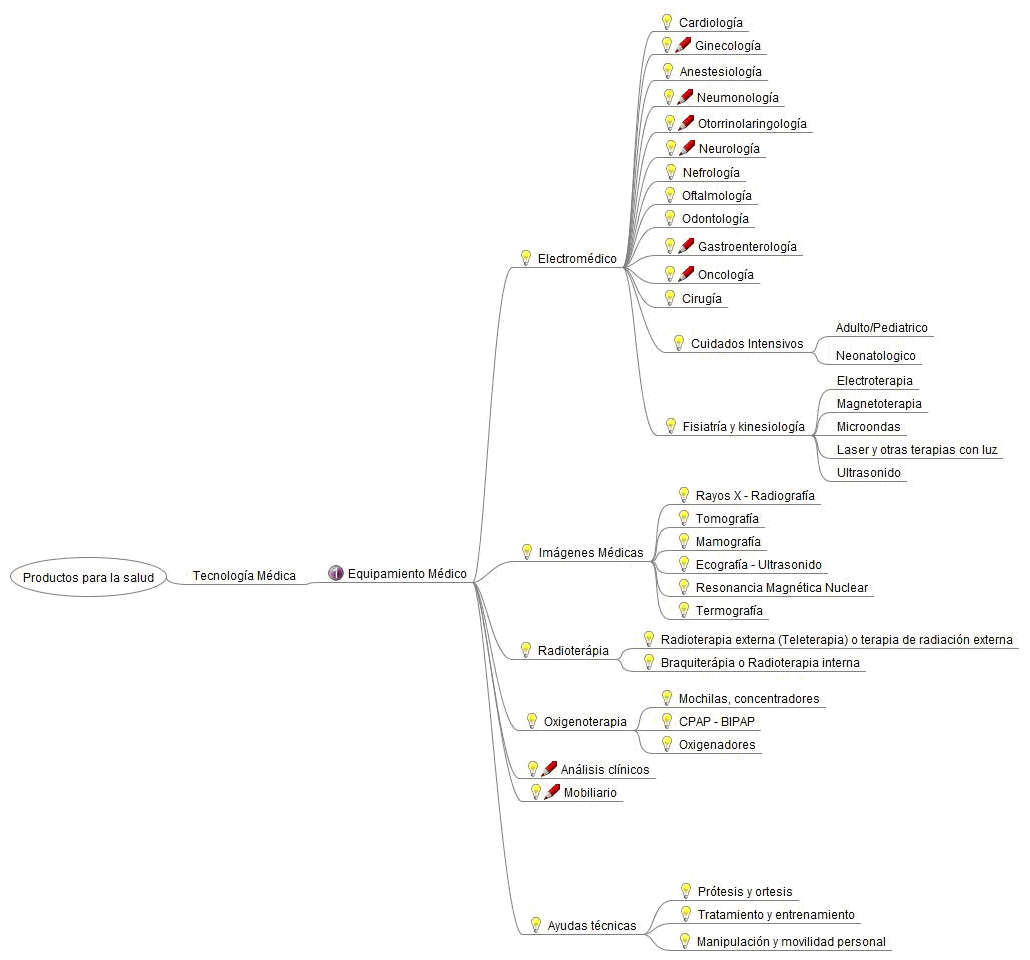
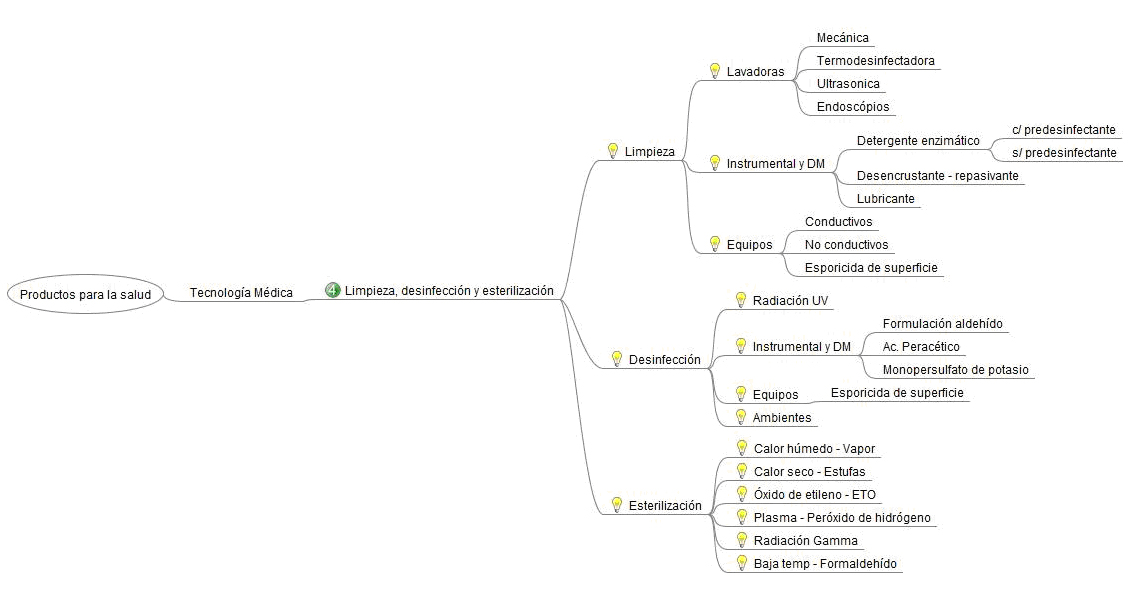
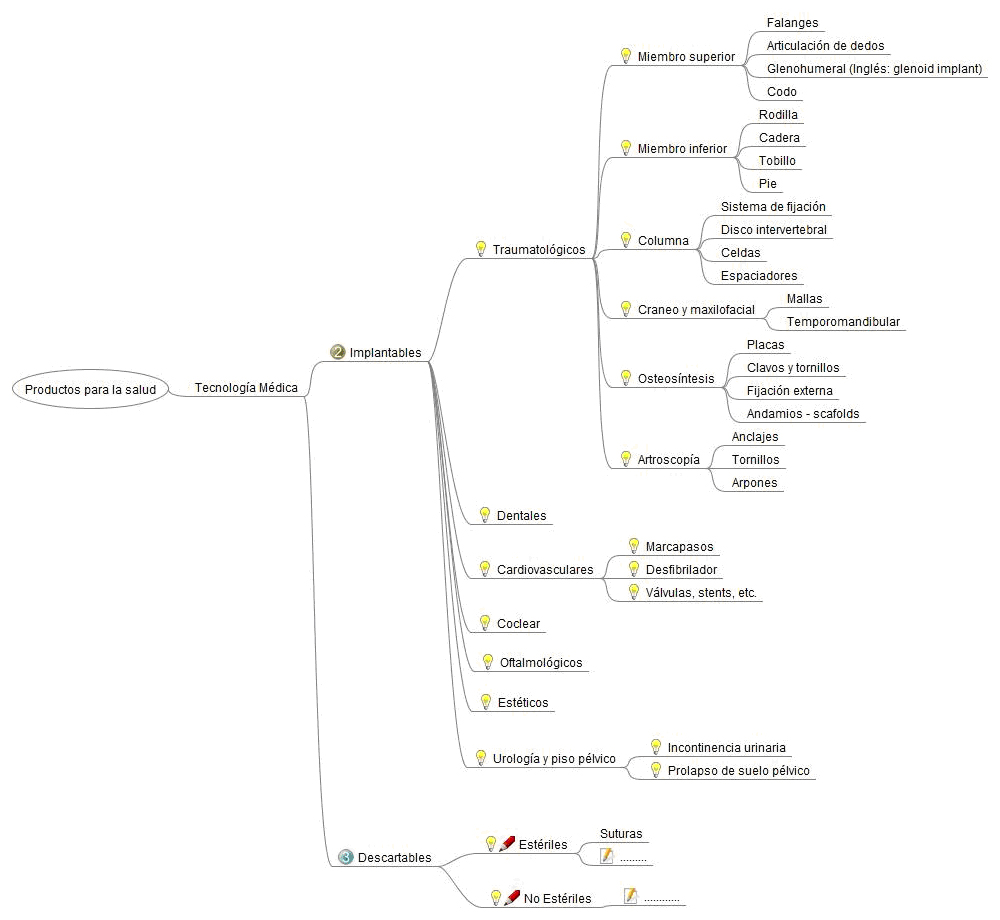
En esta etapa de producción, además de tener en cuenta todo el marco regulatorio, se debe conocer a los proveedores de insumos, ya sea nacionales o importados; y de acuerdo al producto que se va a fabricar, tener en cuenta los proveedores de servicios y el área de radiofísica sanitaria (en caso de ser necesario).
Se debe tener en cuenta a los laboratorios de calibración y ensayos, como así también los laboratorios existentes en el país que cuentan con simuladores de pacientes. Además de las cámaras que nuclean a las empresas y los colegios profesionales, que aportaran estos últimos, el personal calificado para ejercer la función de responsable técnico de las empresas.
En la cadena de valor se observan clasificaciones de equipos en cuadros rojos y verdes, los verdes corresponden a los productos que se fabrican en el país, y los rojos los que aún no se fabrican en Argentina. Esta catalogación de productos es lo que utiliza la ANMAT al momento de ejercer el registro, a través de la Disposición 7425/2013
Distribución y comercialización
Una vez que la empresa cumple con las reglamentaciones del organismo de fiscalización (municipal, provincial y nacional), está en condiciones de poder distribuir y comercializar sus PM. En algunos casos, se hace a través de una distribución propia, o bien, tercerizando esta etapa por medio de distribuidores. En mercado de la fabricación de productos médicos en el país apunta al mercado nacional e internacional.
Esta etapa debe cumplir además con una vigilancia pos comercialización (gestión de riesgo) que alimentará a la etapa de fabricación, garantizando la seguridad para los consumidores.
Disposición final
Los desechos generados por los PM consisten en desechos electrónicos, residuos patogénicos y radioactivos. A nivel regulatorio, es injerencia de los municipios en cada provincia, la reglamentación y control de la disposición final.
1.4 Equipos en uso. En Desarrollo
2. ANMAT
En nuestro país, a través de la Ley Nacional 16.463/64 o ley de “Medicamentos” , en su decreto 1490/92 se crea en su artículo 2 en el ámbito de la SECRETARIA DE SALUD del MINISTERIO DE SALUD Y ACCION SOCIAL, la ADMINISTRACION NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGIA MEDICA (ANMAT); dándole en su artículo 3, competencia para poder controlar y fiscalizar la sanidad y calidad de las drogas, productos químicos, reactivos, formas farmacéuticas, medicamentos, elementos de diagnóstico, materiales y tecnología biomédicos, todo producto de uso y aplicación en la medicina humana; además dependerá del organismo la vigilancia sobre la eficacia y la detección de los efectos adversos que resulten del consumo y utilización de los productos, elementos y materiales antes mencionados, como también tendrá la vigilancia sobre la presencia en los mismos de todo tipo de substancia o residuos, orgánicos e inorgánicos, que puedan afectar la salud de la población.
Todo producto médico para ser utilizado en un paciente debe ser seguro y eficaz, para ello debe ser ensayado y registrado como PM (producto médico) en ANMAT y la empresa fabricante debe estar debidamente habilitada por el organismo antes mencionado. Siempre y cuando se realice transito interprovincial.
Al momento de comenzar con la etapa de I+D+i y hasta el final de la cadena de valor. se debe tener en cuenta a este organismo, ya que dependiendo del tipo de producto que se quiera desarrollar y luego comercializar son los ítems a cumplir. Refriéndose a tipo de producto como la clase de riesgo que tiene el mismo con el paciente.
ANMAT, además de participar de la cada una de las etapas de esta cadena, participa a través de su área de comercio exterior, en el ingreso de algunos componentes que ingresan al país para ser usados en PM.
ANMAT, también participa de la disposición final de los productos, cuando llega a una empresa y se encuentra con un lote vencido donde solicita los papeles de como los desechara.
En el territorio nacional, además de contar con la habilitación nacional, se debe contar con una habilitación municipal y provincial.
3. INTI
El Instituto Nacional de Tecnología Industrial (INTI) fue creado el 27 de diciembre de 1957, en el marco del surgimiento de un conjunto de instituciones nacionales destinadas a poner en movimiento la inversión pública en ciencia y tecnología. El INTI es el referente del Estado Nacional en materia de tecnología industrial y metrología, y su misión es contribuir al desarrollo de la industria a través de la generación y la transferencia de tecnología, la certificación de procesos, productos y personas, y el aseguramiento de la calidad de los bienes y servicios producidos en todo el país.
El INTI cuenta con profesionales de distintas áreas del conocimiento y una experiencia extensa en productos médicos. Los mismos cubren diversos aspectos relacionados con la investigación y desarrollo, análisis y ensayos, asistencia técnica, capacitaciones, certificación, peritajes y producción en plantas piloto. Cuenta con aspectos transversales como envasado, transporte, logística, disposición final, inteligencia estratégica, tecnologías de gestión, sustentabilidad y metrología a través de sus centros que se encuentran distribuidos a lo largo del territorio.
4. Empresas – Industria
El mercado argentino se compone mayoritariamente por empresas PyMEs de intensidad tecnológica variada y ampliamente definida en las siguientes especialidades; electromédicos, un solo uso (descartables), implantables, laboratorio y mobiliario. Caracterizándose el Sector por la convivencia de empresas con tecnología madura, innovadoras y algunas Startups, lo cual contribuye a un desarrollo y conformación virtuosa y de rápida evolución tecnológica. Ello les permite vender sus productos en nichos del mercado mundial dinámicos, donde la competencia se determina vía diferenciación de producto y calidad, produciendo bienes de diversa complejidad, a precios competitivos. Continuidad en desarrollo.
5. Bibliografía
1. DISPOSITIVOS MÉDICOS: la gestión de la Discordancia. Un resultado del Proyecto sobre Dispositivos Médicos Prioritarios. ISBN 978 92 4 356404 3. Año 2012
2. COMPENDIOS DE OMS.
3. https://www.cambridge.org/core/journals/international-journal-of-technology-assessment-in-health-care/article/development-and-implementation-of-health-technology-assessment-in-argentina-two-steps-forward-and-one-step-back/88F9B3BAED5E2DD91E340B144354CD63
4. https://sites.google.com/site/lasaludcomoderechosocial/el-sistema-de-salud-en-argentina